
| 货号 | 规格 | 价格 | 货期 |
|---|---|---|---|
| TBD2013LHU0125 | 200mL/KIT | 1900 1615 | 现货 |
密度梯度分离 > 即用型分离液

| 货号 | 规格 | 价格 | 货期 |
|---|---|---|---|
| TBD2013LHU0125 | 200mL/KIT | 1900 1615 | 现货 |
详细说明
【包装规格】
200ml/Kit
【产品组成】
为方便广大用户使用,试剂内容如下:
名称 | 产品编号 | 规格 | |
|---|---|---|---|
A | 人&各种动物骨髓淋巴细胞分离液 | 200ml | |
B | 组织样本稀释液 (赠品) | 2010C1119 | 200ml |
C | 清 洗 液 (赠 品 ) | 2010X1118 | 200ml |
D | 匀 浆 冲 洗 液 (赠 品 ) | F2013TBD | 200ml |
E | 说明书 | 1 份 |
【实验前准备】
1. 适用仪器
最大离心力可达 1200g 的水平转子离心机。
(离心机使用时调整为慢升慢降(具体参数请咨询离心机厂家)建议升速(指开始启动→达 到设定离心力)的时间、降速(指设定离心时间完成→机器完全停止)时间均控制在 3 分钟 左右。)
2. 实验最佳分离时间
骨髓细胞离体后 2 小时内尽快完成实验。骨髓细胞离体后,时间越长体外细胞活性越差。
3. 分离液的使用环境
a. 分离液需常温(37℃-15℃)避光保存,严禁冷藏冷冻保存;
b. 使用时严格遵守无菌操作规范(超净工作台或生物安全柜内),并在 18℃-22℃环境温 度下进行操作,20℃条件下分离效果最佳。超出此温度范围,有可能使分离液密度发生 改变,造成分离效果不佳。
4. 无菌离心管
序号 | 产品名称 | 产品货号 | 规格 |
|---|---|---|---|
1 | 无菌硅化离心管/10ml(随试剂盒附赠 5 支) | TUB2015 | 100 支/包 |
2 | PBMC 高效离心管/50ml | 601001 | 20 支/盒 |
3 | PBMC 高效离心管/15ml | 601002 | 5 支/包 |
5. 参考值(目的细胞参考范围)
本试剂盒可保证目的细胞的提取率大于 80%,不是纯度。如需获得高纯度目的细胞, 请配合免疫磁珠分选。本试剂盒可减少磁珠的使用量,减少成本。
【检验方法】
全过程样本、试剂及实验环境均需在 20±2℃(试剂需要复温。夏季 20℃, 冬季 25℃。)的条件下进行。
【骨髓单细胞悬液的制备】
1. 人&大型动物需要进行骨髓穿刺手术,来获得骨髓。
2. 大小鼠等小型实验动物以适当方式处死动物,剥离出股骨或胫骨,用剪刀剪断骨头两端, 露出内腔。用注射器吸取适量(根据动物大小)的匀浆冲洗液(产品编号:F2013TBD)冲洗出 内腔中的骨髓。
3. 收集骨髓或骨髓悬液到合适离心管中,反复吹打成单细胞悬液,以 70µm 细胞筛网(产品编号:TBDTM-SC,需要另购)过滤。
4. 以 450g,离心 10min,弃上清。
5. 用组织样本稀释液 (产品编号:2010C1119)重悬细胞浓度为 2×108- 1×109/ml 的单细胞 悬液备用(以小鼠为例,一般使用 1ml 组织样本稀释液重悬骨髓细胞)。
各种规格离心管的使用方法(推荐最佳方法)
取一支无菌离心管,加入分离液,后缓慢加入(人&动物)骨髓单细胞悬液。细胞 悬液小心加于分离液界面之上。(若细胞悬液量较少,需小量分离,分离液的量不得少 于 3ml,细胞悬液在 0.2-2ml 之间)
1. 使用 10ml 无菌硅化离心管
A. 10ml 无菌硅化离心管最佳比例:4ml 分离液+ 0.5-2.0ml 细胞悬液; B. 最佳离心条件:20℃环境下,400g 离心 30min;
注:获得纯度较高的淋巴细胞:离心后,吸取稀释液层由上至下的 2/3 处稀释液,下 1/3 处稀释液可能包含部分 PBMC 及少量分离液成分;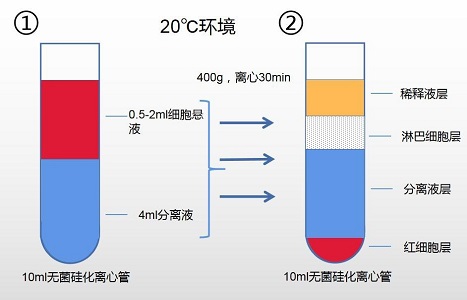
2. 使用 15ml 离心管(或 15ml 高效离心管)
A. 15ml 普通离心管最佳比例:5ml 分离液+ 5ml 细胞悬液;
B. 15ml 高效离心管最佳比例:4ml 分离液+ 5ml 细胞悬液;
C. 最佳离心条件:20℃环境下,600g 离心 25min;
注:获得纯度较高的淋巴细胞:离心后,吸取稀释液层由上至下的 2/3 处稀释液,下 1/3 处稀释液可能包含部分 PBMC 及少量分离液成分;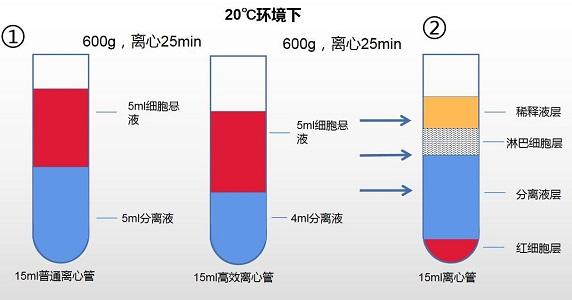
3. 使用 50ml 离心管(或 50ml 高效离心管)
A. 50ml 普通离心管最佳比例:20ml 分离液+ 20ml 细胞悬液;
B. 50ml 高效离心管最佳比例:15ml 分离液+ 20ml 细胞悬液;
C. 最佳离心条件:20℃环境下,600g 离心 30min;
注:获得纯度较高的淋巴细胞:离心后,吸取稀释液层由上至下的 2/3 处稀释液,下 1/3 处稀释液可能包含部分 PBMC 及少量分离液成分。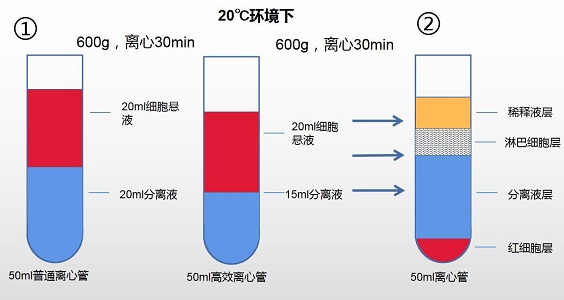
实验后续方案
1. 离心后,离心管中由上至下分为四层。第一层为稀释液层。第二层为环状乳白色(人& 动物)淋巴细胞层。第三层为透明分离液层。第四层为红细胞层。
2. ①小心吸取稀释液层转移到新离心管 A 中。
②小心吸取离心管中的环状乳白色(人&动物)淋巴细胞层转移到新离心管 B 中。
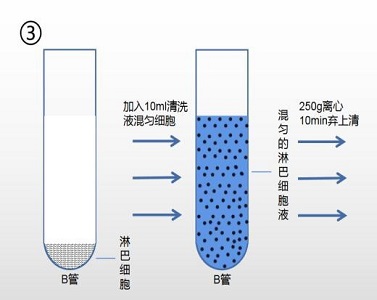
3. 向含有(人&动物)淋巴细胞的离心管 B 中,加入 10ml 清洗液(产品编号:2010X1118),混匀细胞。
4. 250g,离心 10min。弃去上清。
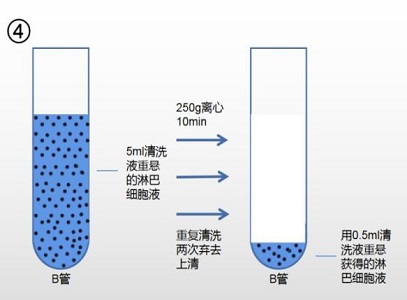
5. 用吸管吸取 5ml 清洗液(产品编号:2010X1118)重悬所得细胞。
6. 250g,离心 10min,弃去上清。
重复清洗两次,弃去上清,用 0.5ml 清洗液(产品编号:2010X1118)或根据下一步实验要 求加入相对应液体,重悬所得细胞。
分离图例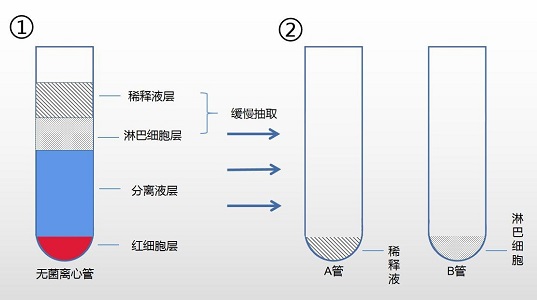
【注意事项】
1. 本实验最好不使用高聚合材质(如聚苯乙烯)的塑料制品,应使用无静电、低静电离心 管及未经碱处理过后的玻璃制品,因为静电作用将导致细胞贴壁、碱处理的玻璃表面会 变成毛面,影响细胞分离效果。
2. 吸取过多的淋巴细胞层及分离液层会导致分离液交界处的粒细胞被吸出从而使混杂的粒 细胞数量增加。
3. 吸取过多的淋巴细胞层上层溶液会导致血浆蛋白及血小板混杂。
4. 分离液用量大于骨髓单细胞悬液样本量时,分离效果更佳。
5. 如实验后细胞得率或活性过低,请联系技术支持。
【储存条件及有效期】
常温保存,有效期 2 年。本品易感染细菌,需无菌条件操作。无菌条件下操作,启 封后置常温保存。如 4℃保存,本分离液易出现白色结晶,影响分离效果。
【参考值(参考范围)】
本实验淋巴细胞提取率大于 80%。
【可能存在的问题及解决方法】
1.由于血液粘度、细胞密度等差异可能造成的问题及解决方案如下表所示:
出现情况 | 出现原因 | 建议解决方案 |
|---|---|---|
离心后目的细胞存在于血浆层或稀释液层 | 转速过小或离心时间过短 | 适当增减转速 |
离心后目的细胞存在于分离液中 | 转速过大或离心时间过长 | |
离心后白环层弥散 | 细胞密度过大 | 调整细胞密度 |
离心后白环层太浅或看不见 | 细胞密度过小 |
2. 离心力公式及单位换算
3. 本分离液分离细胞的原理为密度梯度离心,其密度与温度、大气压等密切相关。不同地 区客户可根据当地情况对离心条件进行适当调整。建议对离心条件进行调整时,恒定离 心时间,对离心转速进行调整。
4. 本分离液依照国际标准,全部使用药用级原料,性能指标与国产同类产品略有不同,可 能出现红细胞沉降不完全的情况,可以适当加大离心转速。
注:在对离心条件进行调整时,离心转速的加减以 50-100g 为基数,直至达到最佳分离效果, 离心力最小不得小于 400g,最大不得大于 1200g。离心时间以 20-30min 为准。
备注:2022.1129-3